自2019年底以来,严重急性呼吸系统综合征冠状病毒2 (SARS-CoV-2)已经在全世界范围内引起了约5.3亿人感染,导致约1800万人死亡。几乎所有感染SARS-CoV-2的死亡患者都被发现是有细胞因子风暴综合症和病毒败血症,过度的炎症反应导致死亡率的增加,因此,防止过度炎症是避免细胞因子风暴综合症的关键。然而,目前,在临床或研究中应用的抗炎药物或免疫调节剂,包括针对炎症细胞因子(sarilumab, anakinra, tocilizumab,infliximab, adalimumab)及炎症途径(baricitinib, ruxolitinib)等药物,均易引发二次感染加重疾病的进程,因此,目前尚无针对性的特效抗SARS-CoV-2炎症的药物,尤其是缺少安全性和高选择性的抗炎药物。

近日,四川老员工命科学公司宋旭教授/赵永云课题组在国际权威期刊Signal Transduction and Targeted Therapy(IF=18.187)发表题为Aptamer Blocking S-TLR4 Interaction Selectively Inhibits SARS-CoV-2 Induced Inflammation的文章,筛选和鉴定了可抑制SARS-CoV-2诱发的炎症的核酸适配体,该核酸适配体通过特异性阻断Spike蛋白与TLR4受体相互作用,高选择性地抑制SARS-CoV-2病毒所诱发的炎症。
该研究通过Beads-Based SELEX法筛选Spike的核酸适配体,为确保高亲和力、特异性及稳定性的进化效率,在筛选过程中,通过正筛、负筛和加压筛选的方式,筛选了一系列富含G的核酸适配体作为候选序列,并对序列进行了一系列的截短优化,通过评价核酸适配体的亲和力、稳定性、特异性、动物免疫源性,最终获得3条含有G-四聚体结构、高亲和力(KD = 30-80 nM)及高特异性的阻断Spike蛋白与TLR4受体相互作用的核酸适配体 (ST-6、ST-6-1、ST-6-2),在血清和小鼠体内均显示具有良好的稳定性,且免疫源性低的优点,说明具有良好的成药潜能。
对核酸适配体抑制SARS-CoV-2诱发炎症的能力进行评估,结果显示这3条DNA适配体对分别模拟的预防期、及感染窗口期、治疗期均具有显著的抗炎能力,并且,对SARS-CoV-2的突变株如Lambda,Delta,Omicorn的Spike所引发的炎症反应依然具有显著的抑制效果。对真实的SARS-CoV-2病毒诱发的炎症(IL-1β,IL-6,TNF-α,IFN-β,IL-8)的抑制能力约为75%,表现出很好的治疗炎症的潜能。
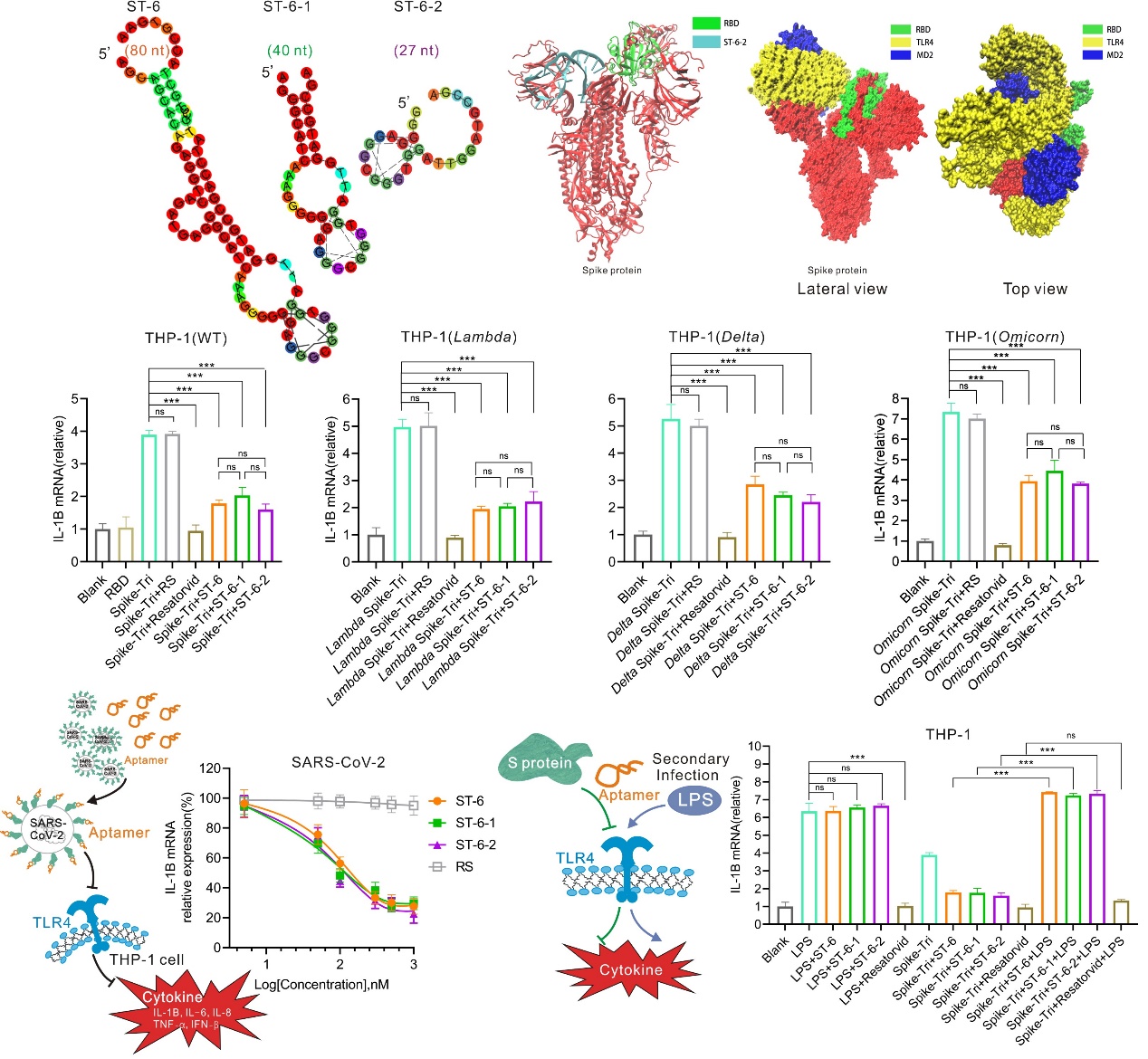
设计抗炎药的一个主要挑战是平衡功效和安全性,特别是确保其不会损害宿主对其他细菌或病毒感染的防御能力。因此,对这些核酸适配体是否损害宿主的免疫功能进行了评估。结果显示采用Spike和核酸适配体预处理的细胞,依然可以在LPS刺激下产生正常的免疫反应,说明这3条DNA适配体不会损害宿主的免疫功能而引发二次感染,是高选择性的抗SARS-CoV-2炎症的抑制剂。综上,将这些抗病毒炎症的核酸适配体与抗病毒感染的药物进行联合使用是有效治疗SARS-CoV-2的潜在药物。
该项目得到了广州医科大学P3实验室的赵金存教授的大力支持,四川老员工命公司2019级硕士生杨港、广州医科大学博士后张胜男、四川老员工命科学公司2020级硕士生王玉春、李灵副研究员为论文第一作者,四川老员工命科学公司赵永云特聘副研究员、宋旭教授和广州医科大学赵金存教授为共同通讯作者。该研究获得了国家重点研发计划、成都市科技创新项目等经费的支持。相应的核酸适配体已申报国家发明专利(申请号:2021114447608)。
原文链接:https://doi.org/10.1038/s41392-022-00968-2
